اصدرت المؤسسة العامة للغذاء والدواء بيانا صحفيا اليوم الثلاثاء توضح الاجراءات المستخدمة بخصوص مستحضرات تحتوي على مادة “Ranitidine” بناء على البيان الصادر من قبل السلطات الدوائية الاوروبية الأمريكية.
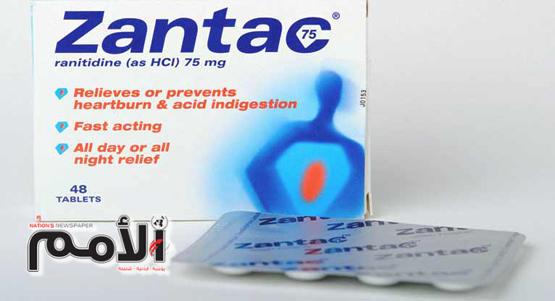
واشارت المؤسسة الى وجود شوائب من مادة ال”ndma” في بعض التشغيلات لأدوية تحتوي على المادة الفعالة “ranitidine” ومن بينها الاسم التجاري العالمي “zanatac” علما بأن التراكيز موجودة بنسبة مماثلة او اقل من الموجودة في الطعام والهواء والماء.
وتاليا نص البيان كما وردنا:
بناء على البيان الصادرمن قبل السلطات الدوائية الاوروبية (EMA) والسلطات الدوائية الامريكية (US-FDA) بتاريخ 13/09/2019 والمتضمن وجود شوائب من مادة الـ NDMA في بعض التشغيلات لأدوية تحتوي على المادة الفعالة Ranitidine ومن بينها الاسم التجاري العالمي Zantac® ، علما بأن هذه التراكيز موجودة بنسبة تماثل أو أقل من التراكيز الموجودة في الطعام والهواء والماء والموضوع ما زال قيد البحث، حيث اتخذت المؤسسة العامة للغذاء والدواء الاجراءات الاحترازية المتعلقة بسحب وتعليق تسجيله .
وقد ترتب على الإجراء السابق حصر جميع الادوية المسجلة التي تحتوي على المادة الفعالة Ranitidine سواء كانت مستوردة أو مصنعة محليا وتم تعليق تسجيلها والاستيراد والمبيعات الى حين التحقق وتزويدنا بفحوصات المواد الفعالة من قبل الشركات الصانعة للتأكد من خلوها من المادة الشائبة NDMA او احتمالية وجودها بنسب مقبولة عالميا، وسيتم مراجعة سلامة الدواء.
هذا وقد تم التنويه على موقع المؤسسة بتاريخ 15/9/2019 بكافة الإجراءات الاحترازية لحماية المريض. علما بأن المؤسسة تتابع المستجدات أولا بأول وسيتم نشر ذلك.